

引言
"单粒药片,‘双引擎’驱动释放速度,还能在胃里超长待机超过12小时?"
双层胃滞留缓释片融合速释层(快速起效)与缓释层(长效释放)的双重释药机制,并借助膨胀技术显著延长胃内滞留时间,是口服缓释制剂中技术壁垒较高的复杂制剂类型。
今天,我们将从药物分析的视角出发,解析在质量研究的核心关键点。
01.药物不同释放机制的特点
1) 速释(IR,Immediate Release)
速释药物是指在给药后能够迅速崩解溶出,药物快速释放并被吸收进入血液的药物制剂。
|
2) 缓释(ER,Extended Release)和胃滞留(GRDDS, Gastro-retentive drug delivery system)
缓释制剂是通过特定的制剂工艺,使药物在体内缓慢释放,从而在较长时间内维持稳定的血药浓度,减少给药频次,提升治疗依从性。胃滞留缓释制剂作为缓释制剂的一种,是一种能够延长药物在胃内滞留时间的口服释药系统,其核心原理是通过特殊设计,使药物在胃中停留时间延长,从而实现局部或全身的持续给药。根据其起效机制和滞留方式,胃滞留缓释制剂大致可分为以下几类:
漂浮型:利用低密度材料(如某些聚合物)或气体(利用碳酸氢钠等气体生成剂,在胃液中产生二氧化碳气体)产生漂浮效果,使制剂在胃液中漂浮,降低或消除胃排空影响,从而延长药物在胃内的滞留时间,进而提高药物的吸收效率和生物利用度。
【晶云星空对于“漂浮”机理的深入思考】:
尽管基于漂浮机理的胃滞留系统(尤其是低密度漂浮片剂)在体外模型中表现出良好的滞胃潜力(如在人工胃液或一杯清水中可持续漂浮数小时),但其在人体内的实际漂浮效能与滞留机制仍存在显著的生理学争议,行业内的专家亦对此提出深刻质疑。
首先,从生理环境的角度来看,胃部的动态条件与静态的体外模型存在根本差异。服药时,患者可能饮用约100-250 mL的水,这些液体在胃中的排空时间通常快于15分钟。除非受试者持续饮水,否则胃内液位将迅速下降,片剂随之失去漂浮所需的液体环境。而进食后,食物与胃酸、消化酶等在胃的蠕动研磨下混合形成粘稠的食糜,此时片剂将被包裹于其中而非自由漂浮于表面。迄今尚缺乏任何证据在这种非均质、高粘度的机械环境中片剂能维持其漂浮状态。
其次,目前支持胃内漂浮的直接人体证据极为有限。多数文献中采用示意图、动画或片剂在烧杯中漂浮的照片来展示片剂漂浮机制;少数研究展示的X光图像也多为受试者在服药后即刻、胃部充满水时拍摄的静态图像,无法证明片剂在进食后或长达数小时的滞留期内仍持续漂浮。缺乏在真实胃环境中(特别是餐后状态)的可视化研究数据,是漂浮机制至今未能得到充分验证的关键缺陷。
因此,在讨论胃滞留制剂的漂浮机制时,我们必须保持审慎态度。成功的胃滞留往往是多种机制协同作用的结果,而非单一漂浮机制所能完全解释,漂浮可能是多种滞留机制(如膨胀、粘附、沉降延迟等)中的一种初始辅助因素,而非唯一或主导机制。盲目强调漂浮作用而不考虑人体胃肠生理的复杂性,不仅可能削弱制剂科学家在这一领域的专业信誉,也可能误导后续的研发方向。未来的研究应更侧重于在体内条件下综合评估制剂的滞留行为,并采用更先进的成像技术(如MRI-磁共振成像、GS-伽马闪烁扫描等)直接观察制剂在胃内的真实状态,以科学验证其滞留机制。
膨胀型:利用亲水性聚合物或膨胀性材料,在胃液中吸水膨胀,体积增大至无法通过幽门(成人的幽门平均直径约9-14 mm,进食后适度闭合,正常状态一般不超过10 mm),从而延长在胃内的滞留时间。而膨胀后体积取决于处方组成。理想的膨胀型胃滞留制剂应该可以在较短时间内水化膨胀到合适的体积,且具有一定的机械强度,保证一定时间内在胃挤压下保持完整。水化膨胀速度和程度取决于亲水性聚合物性质与用量。随着药物的释放,膨胀的骨架会逐渐溶蚀变小,最终随胃内容物排出。如普瑞巴林缓释片(Lyrica CR)。
黏附型:通过在制剂中加入具有生物黏附作用的高分子材料,利用其与胃上皮细胞表面或黏液蛋白表面的黏附作用,增加药物与胃内黏膜的接触时间,改善药物在胃壁的渗透作用,从而延长药物释放时间。如利福平胃滞留片。
高密度型:利用片剂较高的密度(通常超过2.5 g/cm³)使其在胃内沉降并滞留在胃底部。这种制剂的密度高于胃内容物(胃液密度约为1.004 g/cm³),因此能够沉降到胃的底部,并嵌入胃窦的皱襞中,从而抵抗胃的蠕动,延长在胃内的停留时间。
筏型系统:利用凝胶形成聚合物和气体生成剂,形成黏性凝胶层(筏),在胃液中漂浮并持续释放药物。
磁导向型:在赋形剂中加入磁性材料,通过靠近胃外部的磁性探针(外加磁场)的作用,使制剂在胃内滞留,该类型制剂目前仍处于理论研究阶段。
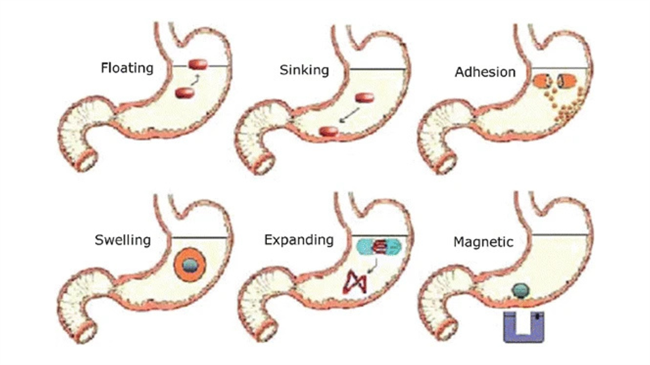
图1 多种胃滞留片的起效机制
|
3)双层胃滞留缓释片(速释层+胃滞留缓释层)
|
02.双层胃滞留缓释片的质量目标
1)双层片外观的“美观性”
目标:两层之间结合紧密,无裂纹,颜色分布均匀,表面光滑平整,稳定性研究期间没有断裂和分层情况。
设计与优化:处方设计,制备工艺优化、压片参数优化,包装条件等。

图 2 扑热息痛双层片
2)"差速药物释放"精准性
目标
速释层:快速释放(0.5-2小时),迅速提高血药浓度,以达到治疗的初始效果。
缓释层:持续平稳释放,维持一定的血药浓度(符合零级或Higuchi模型)。
体内外相关性
速释层:2小时内释放 ≥80%。
缓释层:12小时或更长时间的缓慢释放。
介质:模拟胃液(0.1N HCl)
方法:USP II法(桨法),50 rpm~100 rpm,37 ℃。
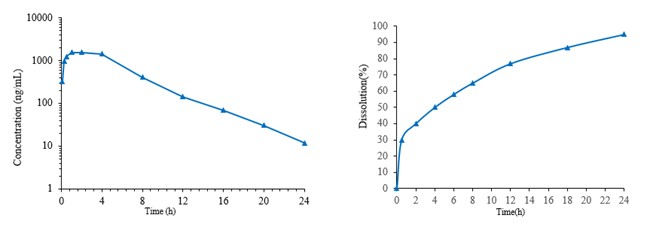
图3 胃滞留双层缓释片PK数据和体外溶出 (GastroPlus模拟曲线)
生理因素:年龄、性别、胃的生理结构的差异,会影响胃滞留片的体内表现。
进食状态:食物的存在会显著影响胃滞留片的滞留时间,从而影响药物生物利用度。
目前,已上市的胃滞留制剂以膨胀、漂浮和黏附型为主,或几种机制协调作用。
处方设计
气体发生剂(NaHCO₃ + 柠檬酸)→ 产生 CO₂ 促漂浮。
低密度材料(脂肪酸、丙烯酸树脂)→ 降低片剂密度。
聚合物选择(如卡波姆,HPMC,PEO等)→ 吸水膨胀,维持浮力和黏度。
工艺因素
压片硬度:过高的压片硬度会延长起漂时间,甚至导致漂浮不稳定,同时也会减慢药物释放。
包衣层:影响水渗透和气体释放。
4)关键质量属性
漂浮滞后时间(FLT): ≤5 min,避免片剂下沉被排空。
总漂浮时间(TFT):≥8-12 h,确保足够的胃滞留。
膨胀尺寸:膨胀后直径>12-15 mm,防止通过幽门。
药物释放:符合缓释要求,如8-12小时释放80%。
体内滞留时间:≥4小时(X射线/PK数据)。
黏附强度:使用黏附力测试仪(如质构分析仪)测量制剂在模拟胃液中的黏附力,一般≥0.1 N/cm²。
凝胶强度测试:吸水膨胀后,凝胶可维持较长时间的稳定,通过测试穿透压力等指标进行评估。
5)稳定性风险
吸湿膨胀导致分层/裂片
PEO缓释层吸湿性强:聚环氧乙烷(PEO)是亲水性凝胶骨架材料,在湿度>75%环境中吸湿增重显著。
层间膨胀差异:速释层(常含崩解剂)与缓释层(PEO)吸湿膨胀系数不匹配。内层PEO膨胀度远高于外层,产生剪切应力引发层间分离或整体裂片。
PEO凝胶特性变化
分子量降解:高湿度或高温下PEO链可能水解断裂,导致分子量下降,影响凝胶层形成速度和机械强度,进而改变药物释放曲线。
发泡剂协同失效:若处方含碳酸盐类发泡剂(如NaHCO₃),吸湿后可能提前反应产气,降低漂浮启动效率。
吸湿后释放行为改变
速释层:吸湿导致崩解剂预水化,崩解时间延长。
缓释层:PEO过度水化使凝胶层增厚,扩散路径延长,药物释放变慢;或因微孔结构塌陷导致释放不完全。
杂质降解
降解机制 | 主要来源 | 受影响API结构类型 | 应对策略 |
氧化降解 | PEO氧化产物,工艺或PEO原料残留 | 酚、胺、硫醚、杂环类 | 加抗氧化剂、 使用低过氧化PEO |
酸催化降解 | PEO氧化生成酸 | 酯、酰胺、水解敏感结构 | 控制局部pH、加缓冲剂 |
金属催化氧化 | PEO吸附金属杂质 | 酚类、芳香胺、易被氧化结构 | 加螯合剂、 控制金属含量 |
03结语
晶云星空拥有成熟的胃滞留制剂技术平台,支持延长药物在胃内停留时间的制剂开发,尤其适用于吸收窗口窄(主要在上消化道吸收、在结肠等下消化道吸收有限)或治疗窗窄的药物,以提升其口服生物利用度。平台可根据药物特性,灵活设计不同剂型(如单层片、双层片等)、释放速率和药物组合,提供个性化的开发方案。平台服务覆盖从处方筛选、工艺开发、中试放大到注册申报的全流程,已有成功案例支持胃滞留制剂进入临床试验阶段。
晶云星空为全球创新药客户提供口服制剂CDMO服务,领导团队拥有在跨国药企平均超过20年的制剂开发和管理经验,主导/参与超过100个创新药的制剂研发和15个创新药的制剂商业化,我们注重D(development,开发)和M(manufacture,生产)的紧密结合,并始终依托“分子-材料-药品”(Molecule-Material-Medicine)的“MMM”策略,致力于为每个创新药分子量身定制适合其分子特性的最佳制剂配方和工艺。
晶云药物始终致力于攻克新药开发中的关键挑战——晶型研究与制剂工艺难题,通过持续创新技术为合作伙伴赋能,加速实现从分子发现到临床推进的转化。公司核心推行 “首次正确”(First-Time-Right )理念,力促在候选药物开发早期即精准锁定最优晶型并确定最佳制剂方案,从源头上规避因早期判断偏差引发的后续返工与延误。通过提供稳定、高效的全流程技术支持,晶云药物最大限度地帮助合作伙伴节省时间与资源,缩短研发周期,从而显著提高新药开发的成功率。
参考资料
[1] Khar, R. K., Vyas, S. P., Ahmad, F. J., & Jain, G. K. (2013). Gastroretentive Drug Delivery Systems. CRC Press. https://doi.org/10.1201/b14636
[2] Singh, B. N., & Kim, K. H. (2000). Gastroretentive drug delivery systems: An approach to oral controlled drug delivery via gastric retention. Journal of Controlled Release, 63(3), 235–259. https://doi.org/10.1016/S0168-3659(99)00204-7
[3] Arora, S., Ali, J., Ahuja, A., Khar, R. K., & Baboota, S. (2005). Floating drug delivery systems: A review. AAPS PharmSciTech, 6(3), E372–E390. https://doi.org/10.1208/pt060347
[4] Talukder, R., & Fassihi, R. (2004). Gastroretentive delivery systems: A mini-review. Drug Development and Industrial Pharmacy, 30(10), 1019–1028. https://doi.org/10.1081/DDC-200033481
[5] Bardonnet, P. L., Faivre, V., Piffaretti, J. C., & Falson, F. (2006). Gastroretentive dosage forms: Overview and special case of helicobacter pylori. International Journal of Pharmaceutics, 277(1–2), 1–13. https://doi.org/10.1016/j.ijpharm.2005.12.029
[6] Streubel, A., Siepmann, J., & Bodmeier, R. (2003). Floating matrix tablets based on low density foam powder: Effects of formulation and processing parameters on drug release. European Journal of Pharmaceutics and Biopharmaceutics, 55(3), 329–335. https://doi.org/10.1016/S0939-6411(02)00171-2
[7] Prajapati, V. B., Jani, G. K., Moradiya, N. G., & Randeria, N. P. (2015). Gastroretentive drug delivery systems: A review. International Journal of Pharmaceutical Investigation, 5(3), 147–157. https://doi.org/10.4103/2230-973X.160848
[8] Chen, R. N., Ho, H. O., & Sheu, M. T. (1999). Characterization of captopril microparticle preparations and the determination of their transport across intestinal epithelial cells. International Journal of Pharmaceutics, 184(2), 161–170. https://doi.org/10.1016/S0378-5173(99)00094-2
[9] Klausner, E. A., Lavy, E., Friedman, M., & Hoffman, A. (2003). Expandable gastroretentive dosage forms. Journal of Controlled Release, 90(2), 143–162. https://doi.org/10.1016/S0168-3659(03)00139-7
[10] Wen, H., & Park, K. (Eds.). (2010). Oral Controlled Release Formulation Design and Drug Delivery: Theory to Practice. Wiley. https://doi.org/10.1002/9780470537240